En 1900, Planck suppose que l’échange d’énergie
entre matière et radiation électromagnétique se fait
de manière discontinue. La valeur des grains ou quanta d’énergie
est
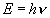 avec h constante
de Planck de valeur : 6, 62.10-34 J.s. En 1905, Einstein
introduit le modèle du photon pour décrire la lumière.
Le photon est un corpuscule de masse nulle, de charge nulle, d’énergie,
qui se déplace à la célérité de la
lumière. Toute radiation peut être décrite comme une
onde (modèle ondulatoire) ou comme une particule, le photon (modèle
corpusculaire).
avec h constante
de Planck de valeur : 6, 62.10-34 J.s. En 1905, Einstein
introduit le modèle du photon pour décrire la lumière.
Le photon est un corpuscule de masse nulle, de charge nulle, d’énergie,
qui se déplace à la célérité de la
lumière. Toute radiation peut être décrite comme une
onde (modèle ondulatoire) ou comme une particule, le photon (modèle
corpusculaire).
Pour Niels Bohr, en 1913, l’émission d’un photon d’énergie
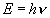 correspond à une diminution
d’énergie de l’atome : son énergie passe d’une valeur
supérieure
correspond à une diminution
d’énergie de l’atome : son énergie passe d’une valeur
supérieure
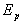 à
une valeur inférieure. On a ainsi :
à
une valeur inférieure. On a ainsi :
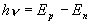 ou
ou
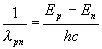
L’absorption d’un photon d’énergie
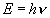 correspond pour l’atome à un accroissement d’énergie de
la valeur
correspond pour l’atome à un accroissement d’énergie de
la valeur
 à la valeur.
Seuls les photons dont l’énergie
à la valeur.
Seuls les photons dont l’énergie
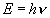 est exactement égale à la valeur
est exactement égale à la valeur
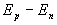 peuvent être absorbés.
peuvent être absorbés.
L’atome d’hydrogène est le plus simple qui soit :
il est formé d’un proton (le noyau) et d’un électron. L’énergie
de l’électron dans le champ du noyau est :
.
Cette énergie est appelée énergie de l’atome.
A toute particule en mouvement, on associe une onde et inversement.
Dans le cas du photon, on a la relation :
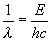
avec l longueur d’onde de l’onde associée et E
énergie du photon.
La longueur d’onde est d’autant plus courte que l’énergie
de la particule est grande.